Pfenex Formycon Coherus Momenta Biosimilarwerte
Quelle:
http://probiosimilars.de/presse/grafik-des-monats-februar-2017/
- AMP Biosimilars AG passt ihr Geschäftsmodell an. -
Frankfurt am Main, 30. März 2017- Der Vorstand der amp biosimilars AG, Frankfurt am Main (ISIN DE000A0SMU87, WKN A0SMU8) passt das bisherige Geschäftsmodell an. Bis jetzt fokussierte sich die Gesellschaft auf die interne Neuentwicklung von Folgeprodukten existierender biotechnologisch hergestellter Medikamente, Biosimilars, für die asiatischen Märkte. Zukünftig wird sich die Gesellschaft verstärkt auf weiter fortgeschrittene Produktkandidaten konzentrieren, welche sie in Partnerschaften mit anderen biopharmazeutischen Unternehmen für die asiatischen Märkte entwickelt. Zusätzlich setzt die Gesellschaft auf Projekte mit Originalpräparaten und nicht mehr ausschließlich auf Biosimilars. Im Zusammenhang mit der Anpassung des Geschäftsmodells soll auf einer außerordentlichen Hauptversammlung über eine Änderung der Firma der Gesellschaft beschlossen werden.
http://www.moneycontrol.com/news/business/...ab-in-india-2251273.html
EXCLUSIVE: Complaints prompt Intas to recall batch of biosimilar Razumab in India
Intas said it is undertaking a detailed analysis on reports of inflammation and has advised doctors to avoid using the product, meant to treat an age-related eye condition, from this specific batch.
https://seekingalpha.com/news/...ation-neulasta-biosimilar-30-percent
Brolucizumab, a humanized single-chain antibody fragment with high affinity for all VEGF-A isoforms, showed efficacy over 48 weeks based on one injection every 12 weeks. EYLEA is administered every eight weeks (after a loading phase for both therapies).
The data analysis is ongoing and will be be submitted for presentation at an upcoming medical conference. The company plans to submit marketing applications in 2018 after completing the pharmacokinetic study with the final manufacturing process.
http://www.ampbiosimilars.com/
Formycon unterzeichnet Term Sheet für Entwicklung von FYB202 und führt Kapitalmaßnahme durch
Formycon AG: Formycon unterzeichnet Term Sheet für Entwicklung von FYB202 und führt Kapitalmaßnahme durch | wallstreet-online.de - Vollständiger Artikel unter:
https://www.wallstreet-online.de/nachricht/...fuehrt-kapitalmassnahme
https://seekingalpha.com/news/...alf-issued-month-end-11_44-per-share
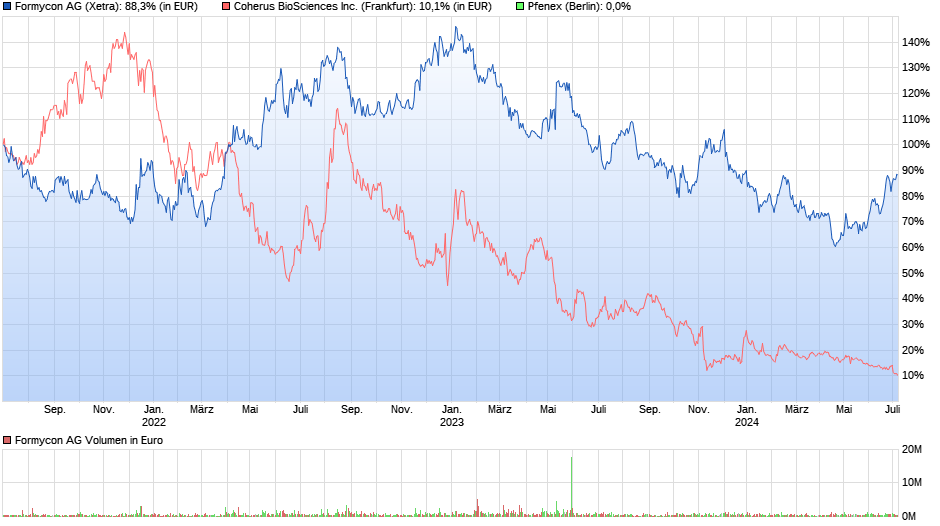 Hier mal ein Vergleich von Formycon zu den beiden Konkurrenten Pfenex und Coherus. In den letzten drei Jahren hat Formycon mit seiner Firmenstrategie die weitaus beste Entwicklung gemacht. Wir müssen jetzt aber auch mal abwarten wie sich die Konkurrenz zu den Formycon Wirkstoffkandidaten verhält. Pfenex hat sein Lucentis Biosimilar eingestellt. Bei Eylea ist bisher auch noch keiner aufgetaucht. Es sieht fast so aus, als würde Formycon der einzige Anbieter bleiben. Selbst wenn Coherus jetzt mit seinem Lucentis Biosimilar Wirkstoff in die Klinik gehen würde, käme man zum Ende der Patentzeit in den USA bedeutend zu spät. In nächster Zeit wurde hierzu von Formycon Neuigkeiten angekündigt.
Hier mal ein Vergleich von Formycon zu den beiden Konkurrenten Pfenex und Coherus. In den letzten drei Jahren hat Formycon mit seiner Firmenstrategie die weitaus beste Entwicklung gemacht. Wir müssen jetzt aber auch mal abwarten wie sich die Konkurrenz zu den Formycon Wirkstoffkandidaten verhält. Pfenex hat sein Lucentis Biosimilar eingestellt. Bei Eylea ist bisher auch noch keiner aufgetaucht. Es sieht fast so aus, als würde Formycon der einzige Anbieter bleiben. Selbst wenn Coherus jetzt mit seinem Lucentis Biosimilar Wirkstoff in die Klinik gehen würde, käme man zum Ende der Patentzeit in den USA bedeutend zu spät. In nächster Zeit wurde hierzu von Formycon Neuigkeiten angekündigt.
Formycon ist mit FYB201 in Phase 3. Einzelheiten zum Stand der Entwicklung können dem Interview oben entnommen werden. Bisher scheinen sie die einzigen zu sein, die das zeitlich hinbekommen.
Pfenex Pf582 liegt weiterhin nach der Rückgabe auf Eis. Es scheint sich bisher zur Weiterentwicklung nach der Phase1 kein neuer Partner finden zu lassen.
Coherus CHS 3351 Sollte dieses Jahr in die klinische Entwicklung kommen. Im Halbjahresbericht werden sie nicht mehr erwähnt. Für den Ablauf der Patente in 2020 kämen sie bedeutend zu spät.
Xbrane mit Xlucane findet bis jetzt auch keinen Partner. Einzig eine Auslizensierung in den Iran schien eine Meldung wert. Doch im Iran besteht eh kein Patentschutz.
Zitat Anfang
Information about ongoing discussions and negotiations concerning out-licensing of Xbrane Biopharma AB's (publ) products
Press release
2017-08-22
In accordance with what has previously been communicated in press releases, interim reports and presentations, Xbrane is in discussions and negotiations with potential partners regarding out-licensing of our Spherotide and Xlucane products.
Negotiation concerning out-licensing of Spherotide in China is proceeding in the right direction and under the same terms as previously communicated. Our ambition is to sign a final agreement this year. Discussions and negotiations regarding out-licensing of Xlucane globally and Spherotide, especially in Europe, are ongoing. Overall commercial terms are agreed upon with a couple of potential partners who are currently undergoing an active evaluation of the products. No decisions have been taken nor agreements have been signed and if/when this happens, Xbrane will communicate such information to the market in accordance with current rules and regulations.
Zitat Ende
Quelle: Xbrane http://xbrane.com/
Aug. 28, 2017 10:41 AM ET|About: Coherus BioSciences (CHRS)|By: Douglas W. House, SA News Editor
Coherus BioSciences (CHRS +3.2%) perks up on light volume in response to its announcement of positive results from the first of three pharmacokinetic bioequivalence (PK/BE) studies comparing biosimilar candidate CHS-1420 to the reference drug Humira (adalimumab). The study met the criteria for clinical PK/BE on all endpoints.
Development is ongoing.
https://seekingalpha.com/news/...equivalence-early-stage-study-shares
loses challenge to AbbVie Humira patents; shares down 5%; AbbVie up 6%
Sep. 7, 2017 1:14 PM ET|About: AbbVie Inc. (ABBV)|By: Douglas W. House, SA News Editor
Coherus BioSciences (CHRS -4.9%) is under pressure on modestly higher volume after it announced that USPTO denied all four of its petitions for Inter Partes review of AbbVie's (ABBV +6.2%) U.S. Patent No. 9,085,619 protecting HUMIRA (adalimumab).
CEO Denny Lanfear says, “While we are disappointed by this outcome, we continue to develop and refine our legal strategies for addressing any patents, including formulation patents, that AbbVie may assert in District Court proceedings."