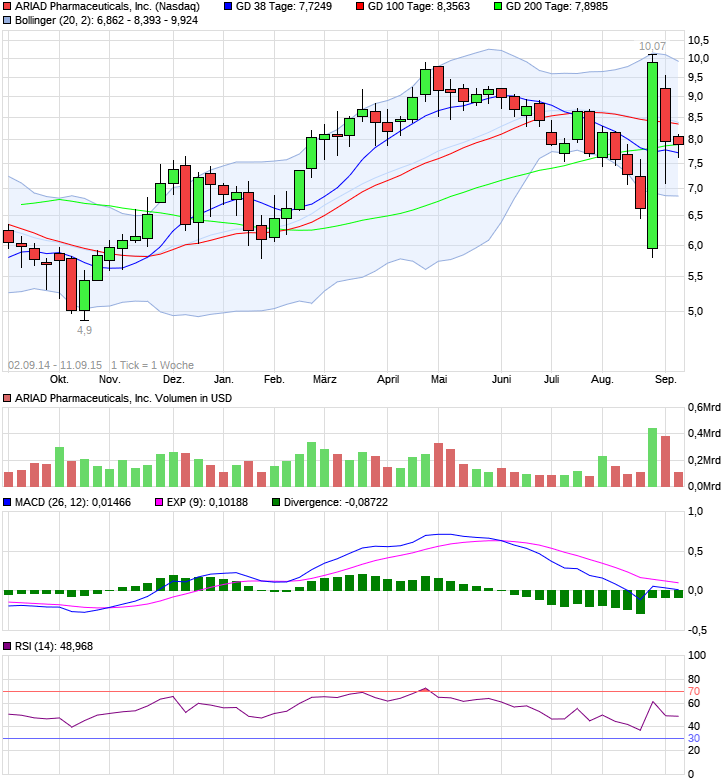
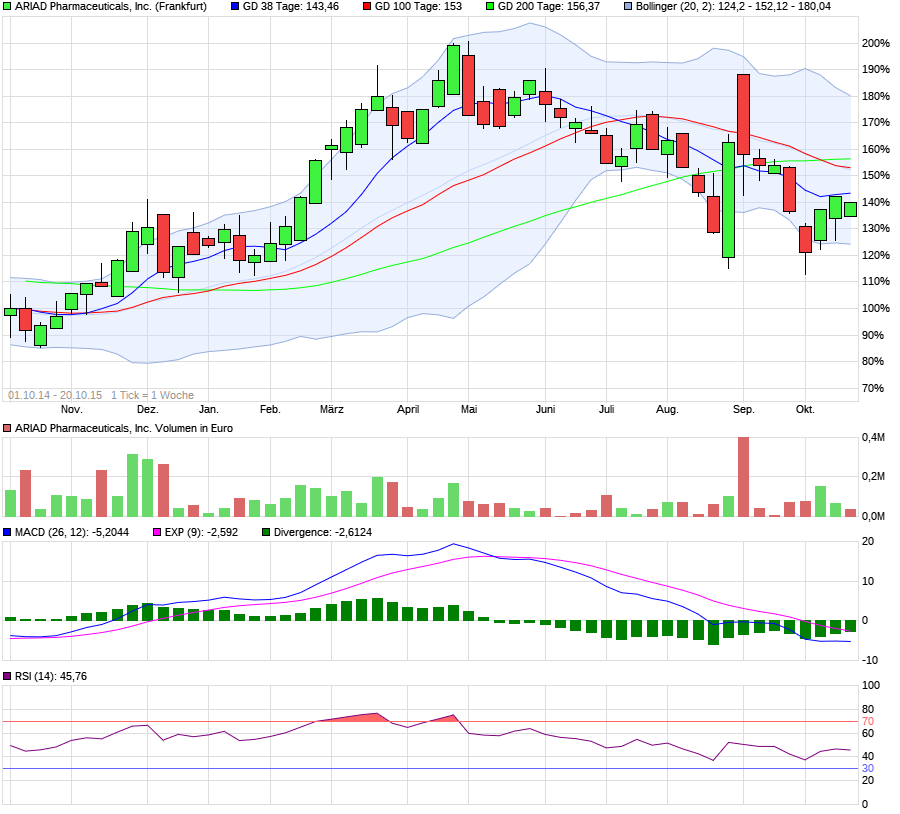
Ariad Pharmaceuticals-Neu
believe me
http://finance.yahoo.com/video/...-quit-ariad-takeover-134328147.html
2. September - Baxalta Inc., der Pharmakonzern Abwehr einer $ 30 Milliarden Übernahmeangebot von Shire Plc, hat sein Streben nach Ariad Pharmaceuticals Inc. aufgegeben, nachdem Verhandlungen scheiterten über Preis, Personen mit Kenntnis der Materie, sagte. Bloombergs Vonnie Quinn berichtet über "Bloomberg Markets."
ARIAD Pharmaceuticals, Inc.
9 Stunden
http://finance.yahoo.com/news/...full-enrollment-phase-113500200.html
CAMBRIDGE, Mass .-- (BUSINESS WIRE) -
ARIAD Pharmaceuticals, Inc. (ARIA) gab heute bekannt, dass das Unternehmen volle Immatrikulation in der Phase 2 ALTA-Studie zum anaplastischen Lymphom-Kinase (ALK) Inhibitor, brigatinib erreicht. Diese Registrierung Studie nahmen rund 220 Patienten in rund 75 Standorten in Nordamerika, Europa und Asien.
"Wir sind stolz darauf, die Patientenrekrutierung in der ALTA-Studie in den Zeitrahmen wir von Anfang an festgelegt abgeschlossen haben", sagte Timothy P. Clackson, Präsident von Forschung und Entwicklung und Chief Scientific Officer von ARIAD. "Wir erwarten, dass Daten aus dieser Studie, um die Basis für ein NDA Einreichung brigatinib bei Patienten mit refraktärem nicht-kleinzelligem Lungenkrebs im dritten Quartal des nächsten Jahres zu bilden."
Die ALTA (A LK in L ung Cancer T rial von A P26113) Studie ist entworfen, um die Sicherheit und Wirksamkeit von brigatinib (früher AP26113 bekannt) in feuerfesten nicht-kleinzelligem Lungenkrebs (NSCLC) Patienten, die positiv für die ALK testen zu bestimmen Oncogene (ALK +) haben und die mit behandelten und Fortschritte auf dem neuesten crizotinib Therapie. Der primäre Endpunkt der Studie ist die objektive Ansprechrate (ORR), wie durch RECIST-Kriterien gemessen. Brigatinib erhalten Durchbruch Therapie von der US Food and Drug Administration im Jahr 2014.
Die mediane Zeit auf die Behandlung von Patienten in der ALTA-Studie ist weniger als 4 Monaten, und Follow-up-Daten sind zu diesem Zeitpunkt beschränkt. Als Ergebnis Jetzt ARIAD erwartet, dass erste Daten aus der Studie werden zur Präsentation auf der American Society of Clinical Oncology (ASCO) im Jahr 2016. Darstellung von Daten auf der ASCO vorgelegt werden auch stärker aufeinander abzustimmen mit der erwarteten Einreichung für die Marktzulassung von brigatinib in den USA im dritten Quartal 2016.
Eine randomisierte Front-Line-klinischen Studie der brigatinib wird erwartet, beginnen Anfang 2016. Diese Phase-3-Studie wird brigatinib zu vergleichen, um in etwa 300 Patienten mit ALK + NSCLC, die nicht vor ALK-Inhibitoren erhalten haben crizotinib.
Über Brigatinib
Brigatinib (AP26113) ist ein Prüfpräparat, zielgerichtete Krebsmedikament intern bei ARIAD Pharmaceuticals entdeckt, Inc. Es ist in der Entwicklung für die Behandlung von Patienten mit ALK + NSCLC, die resistent gegen crizotinib ist. Brigatinib erhalten Durchbruch Therapie Bezeichnung von der FDA im Oktober 2014 auf der Grundlage einer laufenden Phase 1/2 Studie. Brigatinib wird derzeit in der globalen Phase-2-Studie, die ALTA erwartet wird, die Grundlage für seine anfängliche Überprüfung der Rechtsvorschriften zu bilden bewertet.
Über ARIAD
ARIAD Pharmaceuticals, Inc., mit Hauptsitz in Cambridge, Massachusetts und Lausanne, Schweiz, ist ein integriertes, globales Onkologie-Unternehmen, das sich auf das Leben von Krebspatienten mit Durchbruchs Medikamente verwandeln. ARIAD auf neue Medikamente arbeiten, um die Behandlung verschiedener Formen von chronischen und akuten Leukämie, Lungenkrebs und andere schwer zu behandelnde Krebsarten zu fördern. ARIAD nutzt Rechen und strukturelle Ansätze für niedermolekulare Medikamente, die Resistenz gegen bestehende Krebsmedikamente zu überwinden, zu entwerfen. Für weitere Informationen, besuchen Sie http://www.ariad.com oder folgen Sie ARIAD auf Twitter (ARIADPharm).
Zukunftsgerichtete Aussagen
Diese Pressemitteilung enthält zukunftsgerichtete Aussagen, die jeweils in ihrer Gesamtheit durch diesen Warnhinweis eingeschränkt. Alle Aussagen, die hierin enthaltenen beschreiben nicht historische Tatsachen betreffen, einschließlich, aber nicht beschränkt auf, Aussagen in Bezug auf ua: das therapeutische Potenzial von brigatinib; der voraussichtliche Zeitpunkt für Beginn und Abschluss klinischer Studien, Daten aus klinischen Studien Präsentationen und Zulassungsanträge; sowie darauf, dass unsere Phase 2 ALTA-Studie werden die Grundlage für die erste Zulassungsantrag brigatinib die bilden, sind zukunftsgerichtete Aussagen, die auf Erwartungen der Geschäftsleitung und unterliegen bestimmten Faktoren, Risiken und Unsicherheiten, die dazu führen können, Ausgang der Ereignisse, Timing und Performance erheblich von den ausdrücklich oder Aussagen abweichen. Zu diesen Faktoren, Risiken und Unsicherheiten beinhalten, sind aber nicht beschränkt auf, unsere Fähigkeit, erwartete klinische Studie Beginn und Fertigstellungstermine und die regulative Einreichung Termine brigatinib treffen beschränkt; regulatorische Entwicklungen und Sicherheitsfragen, einschließlich Schwierigkeiten oder Verzögerungen bei der Erlangung der behördlichen und Preisfindung und Erstattung Zulassungen unserer Produkte und Produktkandidaten zu vermarkten; unsere Fähigkeit, erfolgreich zu vermarkten und die Gewinne aus dem Verkauf von Iclusig oder anderen Produktkandidaten, einschließlich brigatinib zu erzeugen, wenn er angenommen; Konkurrenz von alternativen Therapien; unsere Abhängigkeit von der Leistung der Drittherstellern für unsere Produkte und Produktkandidaten und auf Spezial-Apotheken für die Verteilung von Iclusig; das Auftreten ungünstiger Sicherheitsereignisse mit unserer Produkte und Produktkandidaten; die Kosten für Forschung, Entwicklung, Herstellung und andere Aktivitäten verbunden sind; die Durchführung und die Ergebnisse der präklinischen und klinischen Studien unserer Produkte und Produktkandidaten, einschließlich der präklinischen Daten und frühen Phase der klinischen Daten dürfen nicht in den späteren Phasen der klinischen Studien repliziert werden; die Angemessenheit unserer Kapitalausstattung und der Verfügbarkeit zusätzlicher Finanzierung; Patentschutz und Drittanbietern an geistigem Eigentum Ansprüche; Risiken für wichtige Mitarbeiter, Märkte, Wirtschaftsbedingungen, Gesundheitsreform, die Preise und Erstattungssätze stehen; und andere Risikofaktoren in unserem öffentlichen Eingaben bei der US Securities and Exchange Commission, einschließlich unseres aktuellen Jahresberichts auf Formular 10-K und nachfolgenden Quartalsberichte auf Formular 10-Q. Sofern nicht anders angegeben, diese zukunftsweisenden Aussagen gelten nur für das Datum dieser Pressemitteilung und wir keine Verpflichtung zur Aktualisierung oder Überarbeitung dieser Aussagen, um Ereignisse oder Umstände, die nach dieser Pressemitteilung eintreten Entwicklungen anzupassen. Wir warnen Investoren sich nicht zu erheblichen Rückgriff auf die in dieser Pressemitteilung enthaltenen zukunftsgerichteten Aussagen zu verlassen.
Quelltext-Version auf businesswire.com: http://www.businesswire.com/news/home/20150915005159/en/
Kontakt:
ARIAD Pharmaceuticals
Für Investoren
Kendra Adams, 617-503-7028
Kendra.adams@ariad.com
oder
Für Medien
Liza heapes, 617-621-2315
Liza.heapes@ariad.com
Habe meinen ehemaligen Gewinn reinvestiert und freue mich somit über einen gesamt-EK von ca. 0,-
Buyout kann kommen ;)
Denke mal spätestens im Frühjahr geht auch der Gesamtmarkt wieder up. Aktuell alles kaum mit anzusehen..
ARIAD Pharmaceuticals, Inc. meldet vorläufige Geschäftsergebnisse für das Quartal zum 30. Juni 2015.
ARIAD Pharmaceuticals, Inc. (ARIA-US) ist eines der ersten Unternehmen unter seiner Vergleichsgruppe, um das Ergebnis für diesen Zeitraum bekannt zu geben.
http://www.capitalcube.com/blog/index.php/...ls-inc-earnings-q2-2015/
Höhepunkte
Zusammenfassung Zahlen: Der Umsatz von USD 29,24 Mio., Nettogewinn von USD -63160000 und Ergebnis je Aktie (EPS) von -0,33 USD.
Die Bruttomarge erhöhte sich von 73,94% auf 88,40% im Vergleich zum gleichen Quartal des Vorjahres, jetzt Betriebs (EBITDA) Margen -190,53% von -451,95%.
Änderung der operativen Cash-Flow von 33,78% im Vergleich zum Vorjahr gleichen Quartal ist ungefähr das Gleiche wie Veränderung des Gewinns, wahrscheinlich keine signifikante Bewegung der Rückstellungen oder Reserven.
Ergebnisrückgang resultiert im Wesentlichen aus nicht-operativen Tätigkeiten, verbesserte Vorsteuermargen von -469,00% bis -214,99%.
Die folgende Tabelle zeigt die vorläufigen Ergebnisse und die neuesten Trends für die wichtigsten Kennzahlen wie Umsatz- und Gewinnsteigerung:
§2014.06.30 2014.09.30 2014.12.31 2015.03.31 2015.06.30
Relevante Numbers (quartalsweise)
Die Umsatzerlöse (mil) 12.11 14,68 66,84 23.99 29.24
Umsatzwachstum (% pa) -13,54 -12,25 700,13 103,62 141,36
Das Ergebnis (mil) -56,92 -50,11 -5,75 -52,68 -63,16
Gewinnwachstum (% pa) 17.49 24.47 92,25 -5,73 -10,96
Nettomarge (%) -469,88 -341,29 -8,6 -219,57 -216,02
EPS -0.3 -0,27 -0.03 -0,28 -0,33
Die Eigenkapitalrendite (%) -169,94 -196,64 -28,42 -354,53 -2.079,68
Return on Assets (%) -54,31 -41,05 -4,23 -35,58 -44,98
Zugriff auf unsere Ratings und Scores für ARIAD Pharmaceuticals, Inc.
Klicken Sie hier um zu sehen
Market Share Versus Profits
Revenues History
Earnings History
Im Vergleich zum gleichen Zeitraum des Vorjahres, ARIA-US 's Veränderung bei den Einnahmen war in der Nähe der Höhe seiner Veränderung des Gewinns. Es bleibt abzuwarten, wie der Rest der Ergebnisse der Vergleichsgruppe der wird sich herausstellen, und wenn sein ARIA-US Leistungs 's ist ein Anzeichen für eine große Veränderung in der Zusammensetzung der Marktanteil in diesem Sektor. Ebenfalls zu Vergleichszwecken, der Umsatz um 21,87% und einem Gewinn von -19,90% gegenüber der Vorperiode verändert.
Gewinnwachstum Analysis
Das Unternehmen ist im Vergleich zum Jahr Ergebnisrückgang nicht als Folge einer Kontraktion der Bruttomargen oder wegen irgendwelcher Kostenkontrolle Fragen zu kommen. Sowohl die Bruttomarge und operative Marge (EBITDA) Margen tatsächlich über diesen Zeitrahmen verbessert. Die Bruttomarge ging von 73,94% auf 88,40%, während die operative Marge verbesserte sich von -451,95% bis -190,53% in diesem Zeitraum. Zum Vergleich wurden die Bruttomargen 85,19% und EBITDA-Margen -195,24% in unmittelbarer letzten Quartal.
Bruttomarge Trend
Unternehmen opfern manchmal Verbesserungen der Umsätze und Margen, um freundlichere Bedingungen Kunden und Lieferanten zu verlängern. Kapital Cube Sonden für solche Aktivitäten durch den Vergleich der Veränderungen der Bruttomargen bei allen Veränderungen im Working Capital. Wenn die Bruttomargen verbessert, ohne eine Verschlechterung des Working Capital ist es möglich, dass die Leistung des Unternehmens ist das Ergebnis einer wahrhaft Bereitstellung auf dem Markt und nicht nur ein Buchhaltungs prop-up mit der Bilanz.
Gross Margin History
Working Capital Days History
ARIA-US Verbesserung ist der Bruttomarge wurde von einer Verbesserung ihrer Bilanz einher als gut. Dies deutet darauf hin, dass die Bruttomarge Verbesserungen sind wahrscheinlich von operativen Entscheidungen und nicht die Buchhaltungstricks. Working Capital Tage haben, um 723,65 Tage von 1,473.88 Tage für den gleichen Zeitraum des Vorjahres zurückgegangen.
Cash Earnings Versus - Sustainable Performance?
ARIA-US 's gegenüber dem Jahreswechsel im operativen Cash Flow von 33,78% ist um seine Ergebnisveränderung. Dies deutet darauf hin, dass es wahrscheinlich keine signifikante Bewegung der Rückstellungen oder Rücklagen für die Verwaltung von Ergebnis in diesem Zeitraum.
Margen
Das Unternehmen die Ergebnisrückgang ist im Wesentlichen eine Folge der nicht-operativen Tätigkeit. In der Tat zeigte das Unternehmen eine Erhöhung der Betriebs (EBIT) Ergebnis vor Steuern und Margen. EBIT-Margen von -464,54% bis -200,46% verbessert und Vorsteuermargen erhöhte sich von -469,00% bis -214,99%.
EBIT Margin History
PreTax Margin History
Zugriff auf unsere Ratings und Scores für ARIAD Pharmaceuticals, Inc.
Klicken Sie hier um zu sehen
Firmenprofil
ARIAD Pharmaceuticals, Inc. betreibt als Onkologie-Unternehmen, das sich auf die Entdeckung, Entwicklung und Vermarktung von niedermolekulare Medikamente zur Behandlung von Krebs eingreift. Zu den Produkten gehören Iclusig (Ponatinib), Brigatinib (früher AP26113 bekannt) und AP32788. Das Unternehmen wurde von Harvey J. Berger im April 1991 gegründet und hat seinen Hauptsitz in Cambridge, MA.
Risikomaterialien
Dieses Arzneimittel unterliegt einer zusätzlichen Überwachung. Dadurch wird eine schnelle Identifizierung neuer Sicherheitsinformation zu ermöglichen. Angehörige der Gesundheitsberufe werden gebeten, alle vermuteten Nebenwirkungen melden. Siehe Abschnitt 4.8, wie Sie Nebenwirkungen zu melden.
https://www.medicines.org.uk/emc/medicine/28145
Das nächste Übernahmeangebot wird wesentlich höher als 10$ sein !!
das wäre ja armselig,
weil das deckt ja gerade mal die Forschungskosten.
Unte 20 $ brauch niemand anklopfen.
http://finance.yahoo.com/news/...conference-call-third-113500039.html
CAMBRIDGE, Mass .-- (BUSINESS WIRE) -
ARIAD Pharmaceuticals, Inc. (ARIA) gab heute bekannt, dass sie ihren dritten Quartal 2015 Finanzergebnisse am Dienstag, 3. November 2015 Bericht zu erstatten, bevor der Markt öffnet. Nach der Ankündigung, um 8:30 Uhr Eastern Time, Unternehmensführung wird eine Telefonkonferenz und ein Webcast Diskussion der Ergebnisse hosten und eine allgemeine Unternehmensupdate.
Die Live-Übertragung kann durch den Besuch der Abschnitt der Website des Unternehmens Investor Relations abgerufen werden http://investor.ariad.com. Der Anruf kann unter der Rufnummer 888 311-8173 (Inland) oder 330-863-3376 (international) 5 Minuten vor der Startzeit und die Bereitstellung der Zugangscode 55634805. Eine Aufzeichnung der Konferenz kann auf der Website ARIAD rund sein zwei Stunden nach Beendigung des Gesprächs und wird für drei Wochen archiviert werden.
Quelle
http://finance.yahoo.com/news/...-posts-wider-expected-142502577.html
Cambridge, MA basiert ARIAD Pharmaceuticals, Inc. ARIA ein biopharmazeutisches Unternehmen, das sich auf die Entdeckung, Entwicklung und Vermarktung innovativer Therapien zur Behandlung von Krebs. ARIAD einzige zugelassene Produkt ist Iclusig (Ponatinib). Iclusig, ein Tyrosinkinase-Inhibitor (TKI), ist sowohl in den USA und der EU für die Behandlung von Erwachsenen mit T315I-positiver chronisch-myeloischer Leukämie zugelassen (chronische, beschleunigte und Blastenphase) oder Philadelphia-Chromosom-positiver akuter lymphoblastischer Leukämie oder für die kein anderen TKI-Therapie zugelassen ist.
ARIAD arbeitet auch an das Studium Iclusig in früheren Therapielinien und beabsichtigt, drei Studien bis zum Jahresende mit einer der Studien, die bereits begonnen zu initiieren. In diesem Szenario wird der Anleger Fokus auf Updates auf die Leistung der Iclusig sowie Bewertung der Fortschritte des Unternehmens mit seinen strategischen Plänen Targeting nachhaltige Profitabilität ab 2018 zu bleiben.
ARIAD hat eine gemischte Erfolgsbilanz mit der Firma zu schlagen Schätzungen in zwei der letzten vier Quartale mit einer durchschnittlichen positiven Ergebnis Überraschung 16.88%. Schätzung Revisionen sind allerdings Flach sowohl für 2015 und 2016.
Derzeit hat ARIAD eine Zacks Platz 3 (Hold), aber das könnte auf jeden Fall folgende Ergebnisbericht der Gesellschaft, die gerade veröffentlicht wurde ändern. Wir haben einige der wichtigsten Statistiken aus dieser just-enthüllt Mitteilungstext unten hervorgehoben:
Das Ergebnis: ARIAD schrieb einen größeren als erwarteten Verlust im dritten Quartal 2015. Unser Konsens für einen Verlust von 20 Cent je Aktie und das Unternehmen nennt einen Verlust von 29 Cent.
Umsatz: Der Umsatz auch hinter den Erwartungen zurück. ARIAD einen Umsatz von 29,1 Mio. $, im Vergleich zu unseren Konsensschätzung von 50 Millionen US $.
Key Stats: Iclusig Umsatz sequenziell im dritten Quartal 2015. Im Juli 2015, in eine nicht-verwässernde Kunst-Lizenzfinanzierungsvertrag mit PDL BioPharma, die sehen konnte, das Unternehmen erhalten bis zu $ 200 Millionen als Umsatz Zinsen im Austausch für die eingegebenen ARIAD Lizenzgebühren auf den Nettoumsatz von Iclusig. Darüber hinaus beendete die Gesellschaft der Aufnahme von Patienten in einer zulassungsrelevanten Phase-II (ALTA) Studie über seine Pipeline Kandidaten, brigatinib. Die Studie wird durchgeführt, um die Sicherheit und Wirksamkeit von brigatinib in feuerfesten nicht-kleinzelligem Lungenkrebs-Patienten, die positiv auf ALK + getestet und wurden zuvor mit Pfizer Xalkori behandelt zu bewerten.
2015 Anleitung: ARIAD weiterhin Iclusig Umsatz im Bereich von $ 130 Millionen auf $ 140.000.000 im Jahr 2015 erwartet.
Prüfen Sie später wieder für unsere volle write up auf dieser ARIAD Ergebnis Bericht später!
Willst du die neuesten Empfehlungen von Zacks Investment Research? Heute können Sie 7 besten Aktien für die nächsten 30 Tage herunterladen. Klicken Sie auf diese kostenlosen Bericht erhalten >>
http://investor.ariad.com/...22&p=irol-newsArticle&ID=2018104
"Wir haben große Fortschritte in unserer gesamten Geschäftsverlauf 2014 - Kommerzialisierung Iclusig® (Ponatinib) und Weiterentwicklung unserer Pipeline, bewegen brigatinib in eine Zulassungsstudie bei Patienten mit refraktärem anaplastischen Lymphom-Kinase-positive nicht-kleinzelligem Lungenkrebs und Nominierungs unserem nächsten Medikamentenkandidaten, AP32788 ", sagte Harvey J. Berger, MD, Vorsitzender und Chief Executive Officer von ARIAD. "Darüber hinaus haben wir unsere Bilanz im vergangenen Jahr mit nicht-verwässernde Finanzierung aus den Vereinbarungen mit Otsuka Pharmaceutical Co., Ltd. und Bellicum Pharmaceuticals, Inc. im Jahr 2015 ist unser Fokus auf dem Ausbau der globalen kommerziellen Chance für Iclusig und strategisch Investition in Mehrwert-Antriebs klinischen Initiativen, um die Gesellschaft für nachhaltiges Wachstum und erwartete Profitabilität im Jahr 2018 die Position "